Este es el protocolo stándard de aislamiento de células dendríticas humanas. Dado que se usa la tinción de inmunofluorescencia con análisis de citometría de flujo, NO se consigue un AISLAMIENTO REAL de la célula mononuclear en este caso de la célula dendrítica.
AISLAMIENTO Y GENERACIÓN DE CÉLULAS DENDRÍTICAS HUMANAS
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4559332/
PROTOCOLO BÁSICO 1: AISLAMIENTO DE CÉLULAS DENDRÍTICAS A PARTIR DE CÉLULAS MONONUCLEARES DE SANGRE HUMANA
Una población de células periféricas puede enriquecerse en células dendríticas mediante el agotamiento de las células T y las células adherentes. A continuación, la preparación se somete a centrifugación en gradiente de densidad sobre metrizamida para aislar células de baja densidad flotante. La población resultante contiene del 20% al 80% de células dendríticas y está mayormente libre de linfocitos.
Anticuerpo secundario marcado con fluorescencia para análisis de citometría de flujo (opcional)
-Tubos de centrífuga cónicos de polipropileno de 15 y 50 ml
9 pulgadas (~23 cm) Pipetas Pasteur, con y sin tapones de algodón
-Placas de cultivo de tejidos de 100 mm
-Rotor Sorvall H1000B (o equivalente)
-Reactivos y equipos adicionales para aislar células mononucleares (UNIDAD 7.1), recuento de células viables (APÉNDICE 3B), formación de rosetas con glóbulos rojos de carnero (UNIDAD 7.2) y análisis de citometría de flujo (UNIDADES 5.3 y 5.4) o evaluación de la actividad funcional mediante leucocitos mixtos reacción (UNIDAD 7.10; ambos procedimientos son opcionales)
Enriquecimieno para células dendríticas mediante centrifugación en gradiente de densidad de metrizamida
18. Determinar la pureza de las células dendríticas mediante tinción de inmunofluorescencia con análisis de citometría de flujo (UNIDADES 5.3 y 5.4) utilizando anticuerpos primarios y secundarios apropiados; por evaluación de la morfología celular (ver Fig. 7.32.1C, D); o por evaluación de la actividad funcional en reacciones de leucocitos mixtos (UNIDAD 7.10).
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4559332/figure/F1/

PROTOCOLO ALTERNATIVO 1: AISLAMIENTO INMUNOMAGNÉTICO DE CÉLULAS DENDRÍTICAS
Se puede aislar una preparación de células enriquecidas en células dendríticas CD83+ como se describe en el Protocolo básico 1 utilizando perlas magnéticas de una población de células de sangre periférica sin células T y células adherentes (consulte la UNIDAD 7.4). Las células dendríticas preparadas por este método generalmente exhiben capacidades morfológicas y funcionales similares a las de las células dendríticas preparadas por selección negativa (consulte el Protocolo básico 1). No es posible aislar células dendríticas CD83+ directamente de preparaciones de células mononucleares sanguíneas porque su frecuencia es demasiado baja.
________________
Los procedimientos utilizados, tanto el MACS como la tinción de control só diferencia las células dentríticas, No se efectúa un AISLAMIENTO REAL de la célula mononuclear dendrítica
Aislamiento de células dendríticas de la sangre del cordón umbilical mediante clasificación o adherencia de células activadas magnéticamente
https://www.spandidos-publications.com/10.3892/ol.2015.3198
Las células dendríticas (DC) son un tipo altamente especializado de células presentadoras de antígenos. El presente estudio describe y compara dos métodos para preparar CD a partir de sangre de cordón umbilical. El primer método implica el aislamiento de DC por clasificación de células activadas magnéticamente (MACS). Esta técnica aísla las células CD34+ de la sangre del cordón umbilical e induce la formación de CD mediante la adición de citocinas, factor estimulante de colonias de granulocitos y macrófagos e interleucina-4. El segundo método implica la generación de un gran número de DC a partir de la sangre del cordón umbilical utilizando un método adherente, que aísla las células mononucleares de la sangre del cordón umbilical e induce las DC en las mismas condiciones que las utilizadas en MACS. Las DC se recolectaron después de 7 días de incubación y se observaron con un microscopio invertido. A continuación, se analizó el fenotipo de las células mediante citometría de flujo. Los resultados revelaron que, después de 7 días de incubación, las CD diferenciadas obtenidas por el método adherente eran más maduras que las aisladas por MACS. Sin embargo, estas células no pudieron mantenerse en cultivo durante más de 9-10 días. Por el contrario, las DC derivadas de células CD34+ por MACS eran fenotípicamente estables y podían mantenerse hasta 3 semanas en cultivo. Cualquiera de los dos métodos producía DC a partir de la sangre del cordón umbilical. Sin embargo, las CD aisladas con el método MACS demostraron mayor homogeneidad, rendimiento y viabilidad que las obtenidas con el método adherente. Debido a las diversas composiciones de los subconjuntos de monocitos aislados, los métodos de aislamiento afectan los fenotipos y las funciones de las DC resultantes.
MACS
Las UBMC se aislaron mediante la selección positiva de células CD34+ utilizando un kit de separación inmunomagnética (MiniMACS CD34 Isolation kit; Miltenyi Biotec GmbH, Bergisch Gladbach, Alemania), según las instrucciones del fabricante. Las células aisladas por el método MACS se lavaron dos veces con solución salina tamponada con fosfato (PBS; GE Healthcare Life Sciences, Logan, UT, EE. UU.) y luego se sembraron en placas de cultivo de seis pocillos (Costar, Cambridge, MA, EE. UU.) a una densidad de 1x106/2 ml por pocillo. Las células se cultivaron en medio RPMI-1640 que contenía suero bovino fetal al 10 % (FBS; Gibco Life Technologies, Carlsbad, CA, EE. UU.) y se complementaron con 1000 U/ml de GM-CSF humano recombinante (PeproTech, Inc., Rocky Hill, NJ , EE. UU.) y 1000 U/ml de IL-4 (PeproTech, Inc.) a 37 °C en una incubadora con atmósfera humidificada al 5 % de CO2.
Generación de células dendríticas
Cada tres días, el 50 % del medio gastado se reemplazó con medio nuevo que contenía GM-CSF e IL-4 para producir concentraciones finales de 1000 U/ml. El quinto día, las células se cultivaron en TNF-α (PeproTech, Inc.) durante dos días más. Después de 7 días de cultivo, se recolectaron las DC.
Análisis basado en el flujo de células marcadas
Las CD se lavaron dos veces con PBS y luego se incubaron en una solución de bloqueo del receptor Fc (FcR) al 10 % (Miltenyi Biotec GmbH) durante 30 min a 4 °C para bloquear la unión no específica al FcR. A continuación, las células se tiñeron con ficoeritrina (PE) conjugada con ficoeritrina (PE) monoclonal de ratón anti-grupo humano de diferenciación (CD) 80 (1:100; n.º de cat. ab-155374; Abcam, Cambridge, MA, EE. UU.) y anti monoclonal de ratón. -antígeno leucocitario humano humano (HLA)-DR (1:100; n.° de cat. ab95830; Abcam) anticuerpos o anticuerpos monoclonales de ratón anti-CD11c humanos conjugados con APC (1:100; n.° de cat. 657713; BD Biosciences, Franklin Lakes, NJ, EE. UU.), mientras que la tinción de control se realizó utilizando anticuerpos irrelevantes de isotipo coincidente que también se conjugaron directamente con PE o APC. La intensidad de fluorescencia de las células se analizó utilizando un sistema de citometría de flujo FACS Calibur (BD Biosciences).
análisis estadístico
Los datos de cada figura corresponden a un experimento representativo de al menos tres experimentos independientes. Se utilizó una prueba t para determinar la importancia de la comparación de datos. Se utilizó un análisis de varianza de una vía para el análisis estadístico de las diferencias entre los grupos experimentales. Todos los análisis estadísticos se realizaron con el software estadístico SPSS 19.0 (SPSS, Inc., Chicago, IL, EE. UU.). Se utilizó un valor de P<0,05 para indicar una diferencia estadísticamente significativa.
Resultados
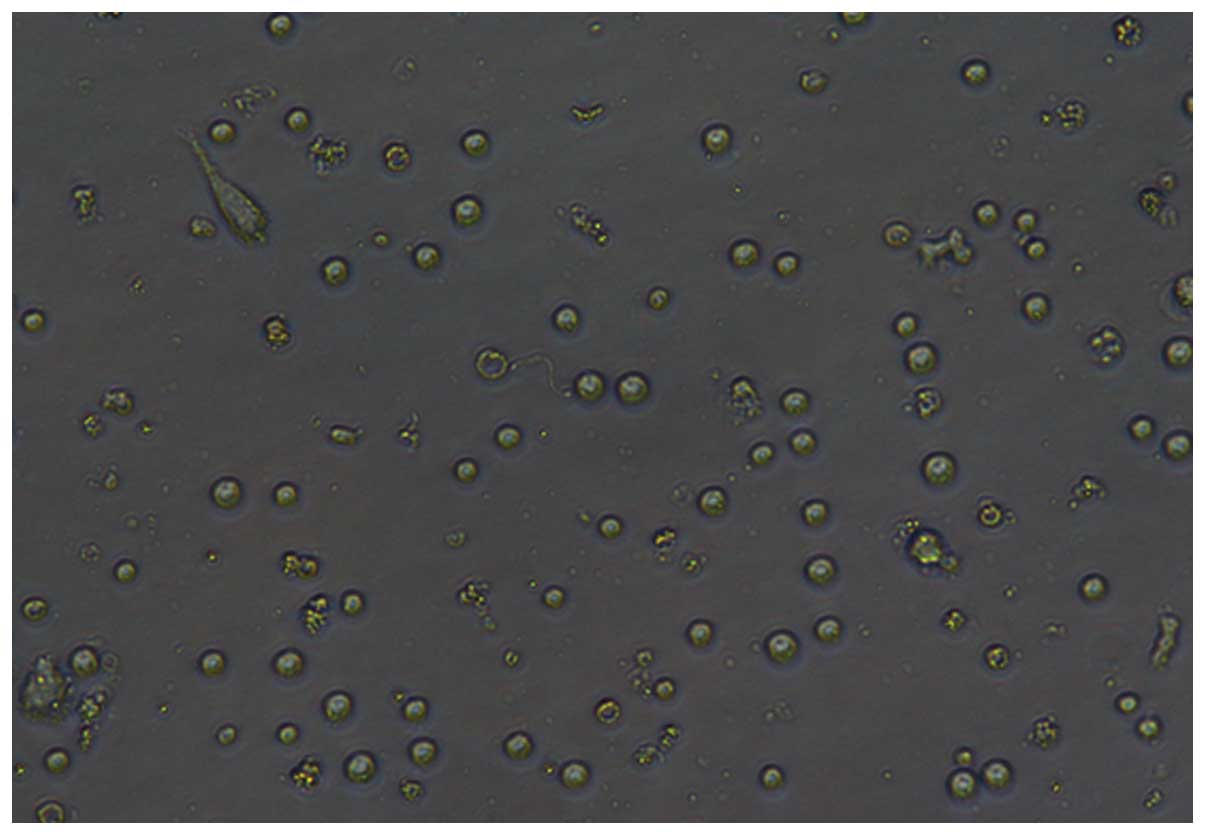
Después de 7 días de incubación, se capturaron imágenes microscópicas de las DC con un microscopio invertido (IX51; Olympus Corporation, Tokio, Japón) usando el objetivo x10 o x20 (Figs. 1–4).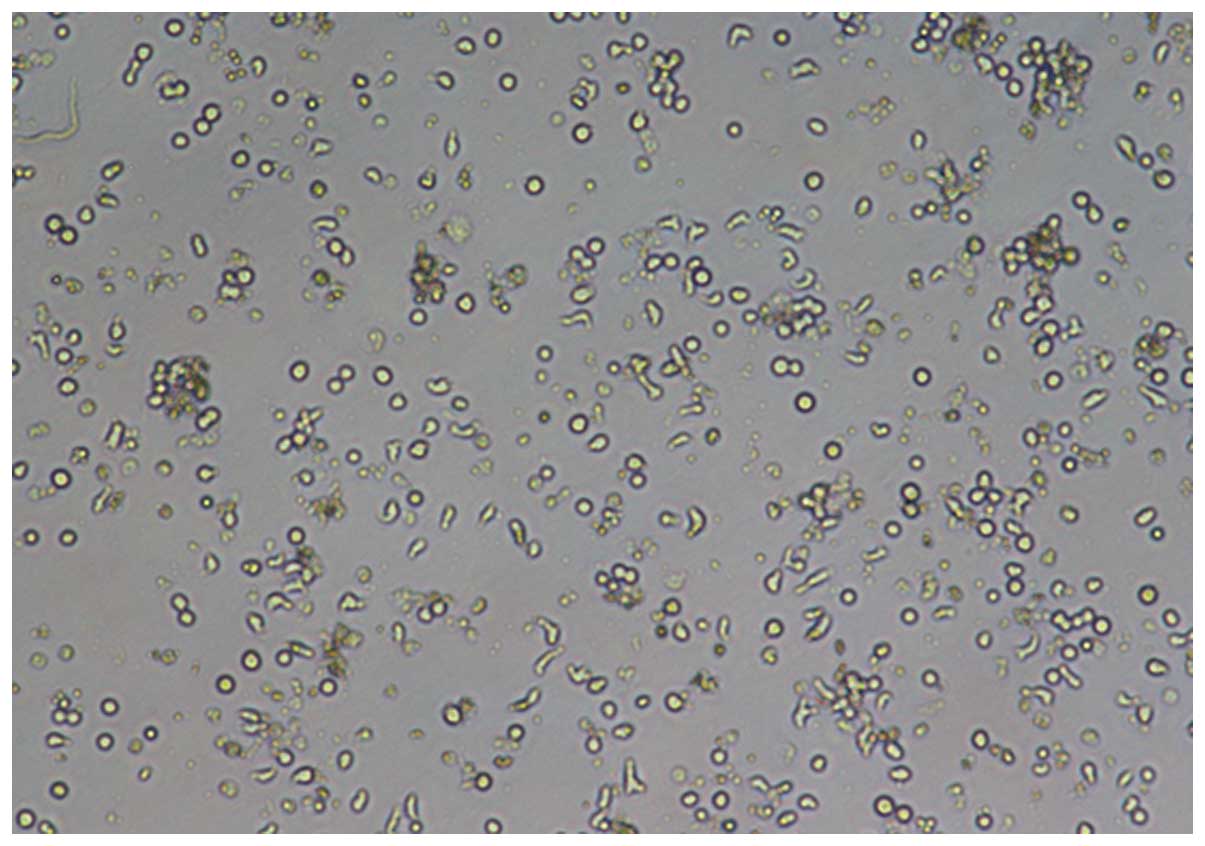

No hay comentarios:
Publicar un comentario