la Dra. Jeyanthi Kunadhasan miembro del equipo de voluntarios de DailyClout que formaron la base de la Autorización de Uso de Emergencia (EUA) acusa a PFIZER de OCULTAR 6 muertes en sus ensayos clínicos
Pfizer no reveló una “muerte cardíaca súbita” de una persona vacunada en Kansas en su ensayo clínico contra la COVID-19 – Carta de la Dra. Jeyanthi Kunadhasan al fiscal general de Kansas, Kris Kobach
December 4, 2024 • by Jeyanthi Kunadhasan, MD (UKM), MMed (AnaesUM), FANZCA MMED (Monash)
Estimado Fiscal General Kobach:
Mi nombre es Dra. Jeyanthi Kunadhasan y soy anestesista y médica perioperatoria en Australia. También soy miembro del equipo de voluntarios de DailyClout que está investigando los datos, publicados en el sitio web de Salud Pública y Profesionales Médicos por la Transparencia[1], que formaron la base de la Autorización de Uso de Emergencia (EUA) de la Administración de Alimentos y Medicamentos de la vacuna de ARNm BNT162b2 contra la COVID-19 de Pfizer-BioNTech. Además, soy la Tesorera de la Sociedad Australiana de Profesionales Médicos.[2]
Fui coautora de los informes de análisis de documentos de Pfizer de WarRoom/DailyClout 42[3] y 76[4], disponibles en dailyclout.io. También soy coautor de “Análisis forense de las 38 muertes de sujetos en el informe provisional de 6 meses del ensayo clínico de la vacuna de ARNm BNT162b2 de Pfizer-BioNTech”,[5] que es el primer análisis de los datos del ensayo original de la vacuna de ARNm BNT162b2 de Pfizer-BioNTech realizado por un grupo no afiliado al patrocinador del ensayo clínico.
Tomo nota con interés de su demanda contra Pfizer. Me gustaría llamar su atención sobre la muerte no revelada de un participante de Kansas que ocurrió en el brazo vacunado con BNT162b2 del ensayo clínico de Pfizer, como se informó originalmente en el Informe 89 de War Room/DailyClout, ‘Los investigadores descubren que Pfizer retrasó el registro de las muertes por vacunación en una coyuntura crítica del proceso de EUA. Los retrasos inadecuados en la notificación de muertes en los vacunados llevaron a la FDA a tergiversar la eficacia de la vacuna e influyeron en la decisión de conceder la EUA.[6]
Como usted sabe, los hallazgos del ensayo clínico C4591001 que supuestamente respaldan la seguridad y eficacia de la vacuna de ARNm BNT162b2 se han publicado dos veces. Polack et al. publicaron por primera vez los hallazgos el 10 de diciembre de 2020, un día antes de que la FDA emitiera la EUA, con el título “Seguridad y eficacia de la vacuna de ARNm BNT162b2 contra la COVID-19”[7]. Luego, el 15 de septiembre de 2021, Stephen J. Thomas, MD, et al. publicó, “Seguridad y eficacia de la vacuna de ARNm BNT162b2 contra la COVID-19 durante 6 meses”. [8] La publicación de Polack en el NEJM afirmó: “Todos los datos del ensayo estaban disponibles para todos los autores, quienes avalan su precisión e integridad y la adherencia del ensayo al protocolo, que está disponible con el texto completo de este artículo en NEJM.org. Un comité independiente de monitoreo de datos y seguridad revisó la eficacia y los datos de seguridad no ciegos”. (Polack et al., 2020)
El artículo de Polack reveló seis muertes: dos en el grupo BNT162b2 y cuatro en el grupo placebo. En el artículo de la revista y la documentación de aprobación de la EUA[9], las seis muertes cubrieron el período del 27 de julio de 2020 al 14 de noviembre de 2020. Esta carta demostrará que Pfizer-BioNTech poseía registros que mostraban que Pfizer debería haber revelado a la FDA ocho muertes, cuatro en el grupo BNT162b2 y cuatro en el grupo Placebo. Además, las dos muertes no reveladas presentaron una señal de evento cardíaco en los receptores de BNT162b2 del ensayo clínico. Una de las muertes no reveladas en el grupo vacunado del ensayo ocurrió en Kansas.
El protocolo del ensayo clínico de Pfizer requería que los eventos adversos graves (EAG) se informaran inmediatamente después de la toma de conciencia, y bajo ninguna circunstancia que excediera las 24 horas, a Pfizer Safety en el Formulario de Informe de EAG de la Vacuna.[10] El protocolo requería que los investigadores del sitio registraran en el Formulario de Informe de Caso (CRF) del paciente todos los eventos adversos observados directamente y todos los eventos adversos informados espontáneamente y los eventos adversos graves informados por el participante. En caso de muerte, se confiaba en que el pariente más cercano o el contacto de emergencia informaran al centro de ensayos clínicos sobre la muerte de un participante, a diferencia de la autonotificación de otros eventos adversos. La notificación rápida al patrocinador del ensayo, por parte del investigador del centro de ensayos clínicos, de un evento adverso grave fue esencial para cumplir con las obligaciones legales y las responsabilidades éticas con respecto a la seguridad de los participantes y la seguridad de una intervención del estudio bajo investigación clínica. El patrocinador, en este caso BioNTech, tenía la responsabilidad legal de notificar tanto a la autoridad regulatoria local como a otras agencias regulatorias sobre la seguridad de la intervención del estudio bajo investigación clínica. El patrocinador debía cumplir con los requisitos regulatorios específicos del país relacionados con la notificación de seguridad a la autoridad regulatoria, las Juntas de Revisión Independiente (IRB)/Comités de Ética (CE) e investigadores.
Si observamos la siguiente tabla, que está adaptada del “Análisis forense de las 38 muertes de sujetos en el informe provisional de 6 meses del ensayo clínico de la vacuna de ARNm BNT162b2 de Pfizer/BioNTech”) (Michels et al., 2023), podemos ver que, hasta la fecha límite de datos del 14 de noviembre de 2020, hubo 11 muertes (seis muertes en el grupo vacunado del estudio y cinco en el grupo placebo), en contraste con las seis muertes divulgadas públicamente en la reunión de VRBPAC y en el artículo de Polack. Aparentemente, hubo una tasa de captura del 33 % (dos muertes informadas de seis muertes) en el grupo vacunado frente a una tasa de captura del 80 % en el grupo placebo (cuatro muertes informadas de cinco muertes).

Para determinar cómo se produjeron las discrepancias en las muertes notificadas, mis colegas investigadores y yo partimos de la premisa de que, al 14 de noviembre de 2020, Pfizer-BioNTech no había sido informada de ninguna muerte durante el ensayo. La única forma de refutar esto de forma válida era demostrar, mediante registros disponibles públicamente, que Pfizer-BioNTech tenía conocimiento de las muertes. Tras examinar minuciosamente cada una de las notas de los pacientes publicadas por la FDA y disponibles públicamente en el sitio web de Profesionales Médicos y de Salud Pública por la Transparencia (PHMPT), identificamos a los seis sujetos fallecidos, cuyas muertes se informaron en la publicación inicial de Polack, así como en la reunión de VRBPAC el 10 de diciembre de 2020. Se trata de los sujetos vacunados 11621327 y 10071101, así como de los sujetos no vacunados 11521085, 12313972, 10661350 y 10811194. Sus muertes ocurrieron antes del 14 de noviembre de 2020 y había documentación de sus muertes antes del 14 de noviembre de 2020 en sus respectivos CRF.
Los dos sujetos BNT162b2 cuyas muertes se incluyeron en la presentación de la EUA:

Los cuatro sujetos placebo cuyas muertes se incluyeron en la presentación de la EUA:

Una vez establecido que Pfizer-BioNTech utilizó la entrada de datos de la notificación de muerte en el CRF como el único punto de datos que determinaba si se informaba una muerte, nuestra investigación de los registros públicos en ese momento no pudo proporcionar respuestas sobre por qué no se informaron las otras muertes.
Sin embargo, los datos de Pfizer-BioNTech de septiembre de 2023 publicados por la FDA proporcionaron un documento titulado “125742_S1_M5_5351_c4591001-interim-mth6-narrative-sensitive.pdf”[11] que incluía información que mostraba que, de hecho, Pfizer-BioNTech fue informado de dos muertes adicionales en el grupo BNT162b2 del ensayo mucho antes del corte de datos de la EUA y que esas muertes no se revelaron a la FDA. Si las dos muertes adicionales se hubieran revelado en el momento de la EUA, se habría demostrado que la intervención de la vacuna COVID de ARNm BNT162b2 no proporcionó ninguna reducción en las muertes.
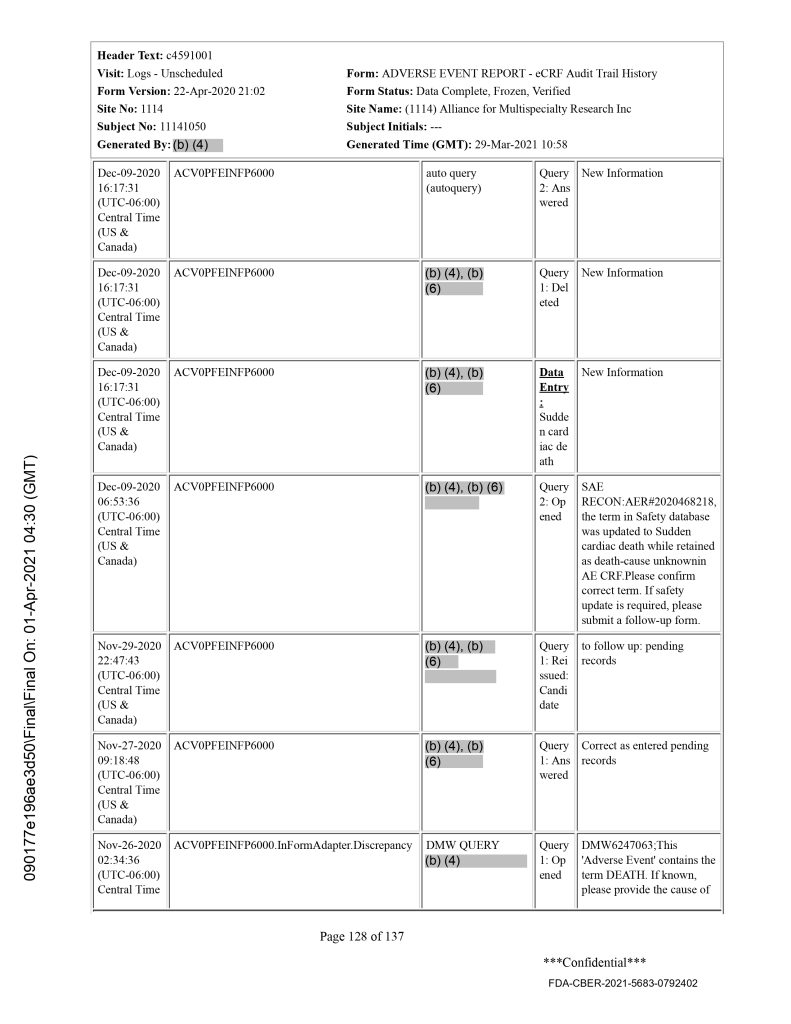
El sujeto 11141050, una mujer de 63 años de edad, se inscribió en el ensayo de la vacuna Pfizer (C4591001) en Alliance for Multispecialty Research LLC, en Newton, condado de Harvey, 67114 Kansas. El investigador principal en este sitio fue el Dr. Richard Glover.[12]
El sujeto 11141050 tenía un sobrepeso leve, con un IMC de 27. Era posmenopáusica, tenía depresión, hipertensión, osteoporosis, artritis reumatoide y apnea del sueño. Sus medicamentos incluían trazodona (desde el 1 de enero de 2005) y sertralina (desde el 1 de julio de 2020) para la depresión; pregabalina (desde el 1 de enero de 2005) y baclofeno (desde el 1 de enero de 2018) para la enfermedad degenerativa del disco; así como amlodipino (desde el 1 de enero de 2010) e hidralazina (desde el 1 de febrero de 2020) para la hipertensión.[13]
Después de completar el proceso de detección y las pruebas correspondientes, recibió su primera dosis de BNT162b2 el 18 de agosto de 2020 y la segunda dosis el 8 de septiembre de 2020. Se presentó para el seguimiento de un mes, después de la segunda dosis, el 7 de octubre de 2020 y se le realizaron las pruebas de seguimiento correspondientes en ese momento.[14] No hay documentación de ningún evento clínico adverso durante estas visitas.
Murió 41 días después de recibir la segunda dosis de BNT162b2 el 19 de octubre de 2020, y solo 12 días después de su visita de seguimiento planificada. El contacto de emergencia informó al centro clínico sobre la muerte el 19 de octubre de 2020.[15]
La muerte de este sujeto no fue revelada en la publicación de Polack en el NEJM (Polack et al., 2020), ni en la reunión del VRBPAC del 10 de diciembre de 2020.[16] El propio protocolo de ensayos clínicos de Pfizer-BioNTech indicó que debería haberse revelado.
La muerte ocurrió mucho antes de la fecha límite de datos del 14 de noviembre de 2020. En las narraciones de los pacientes (Pfizer, 2023, p. 71), se puede ver que el contacto de emergencia confirmó el día de la muerte (19 de octubre de 2020) que el sujeto había muerto. Los documentos narrativos indican además que se le realizó una autopsia al sujeto, a partir de la cual se determinó que la causa de la muerte fue “muerte cardíaca súbita”.
Cuando revisé el Formulario de Informe de Caso (CRF) de este sujeto, encontré que el diagnóstico particular de “muerte cardíaca súbita” se había mencionado el 9 de diciembre de 2020.[17] En la página 71 del CRF de este sujeto, la fecha de notificación de la muerte es el 25 de noviembre de 2020. Dado que el centro clínico había sido informado por el contacto de emergencia el día en que murió el paciente, vemos que hubo una demora de 37 días en registrar esta muerte en el CRF, en contravención del protocolo de ensayo de Pfizer. Como esta muerte ocurrió mucho antes de la fecha límite de datos del 14 de noviembre de 2020 y se conoció el 25 de noviembre de 2020, hubo una amplia oportunidad de divulgar la muerte de este sujeto, y posiblemente los resultados de la autopsia, en la reunión del VRBPAC del 10 de diciembre de 2020.
Según la autopsia, la paciente murió de "muerte cardíaca súbita", y sus factores de riesgo conocidos de hipertensión y obesidad la colocaban en alto riesgo de infarto agudo de miocardio cardíaco. El personal del sitio clínico ingresó el diagnóstico específico de “muerte cardíaca súbita” en sus notas el 9 de diciembre de 2020, el día antes de la reunión del VRBPAC el 10 de diciembre de 2020, lo que sugiere que esta muerte oculta también tenía resultados de autopsia disponibles en el momento crítico de la consideración de la Autorización de Uso de Emergencia de la vacuna.

https://phmpt.org/wp-content/uploads/2023/05/125742_S1_M5_CRF_c4591001-1114-11141050.pdf#page=128, p. 128.
Para ser elegibles para ser incluidos en este ensayo clínico, los participantes debían ser considerados saludables en base a su historia clínica, examen físico (si era necesario) y el criterio clínico del investigador. El protocolo permitió que los participantes sanos con enfermedad estable preexistente (definida como enfermedad que no requirió un cambio significativo en la terapia u hospitalización por empeoramiento de la enfermedad durante las seis semanas anteriores a la inscripción) participaran en el ensayo clínico. Esta paciente estaba medicada con dos antihipertensivos diferentes y había tenido contacto con el personal del ensayo clínico al menos tres veces sin mencionar ninguna lectura de presión arterial preocupantemente alta. De hecho, no puedo encontrar ninguna lectura de presión arterial en sus notas de caso disponibles públicamente. En consecuencia, solo puedo suponer que la presión arterial alta de la paciente, que había sufrido desde el 1 de enero de 2010, estaba bien controlada cuando fue admitida en el ensayo.
La paciente medía 165 cm y pesaba 74,1 kg. Por lo tanto, su IMC de 27,2 la colocaba en la categoría de sobrepeso, no de obesidad. Sin revisar los resultados de la autopsia, será difícil creer que tales lecturas antropométricas ponen a una persona en alto riesgo de muerte cardíaca súbita.

https://www.phmpt.org/wp-content/uploads/2023/05/125742_S1_M5_CRF_c4591001-1114-11141050.pdf, p. 10.
Se necesita una mayor investigación sobre la conclusión del patrocinador clínico de que esta muerte no revelada en el grupo vacunado no se debió a la vacuna. ¿Sobre qué base se tomó esta determinación? Este paciente tiene un resultado de autopsia que todavía no está disponible públicamente. Esta autopsia no se reveló en el momento más crítico, antes de la autorización del fármaco. Los resultados de esta autopsia deben hacerse públicos para que los examinen expertos independientes.
Es extremadamente importante saber
Cuándo el centro clínico 1114 recibió la notificación de la muerte y si hubo una notificación oportuna al patrocinador del ensayo clínico, Pfizer-BioNTech.
Cuándo se realizó la autopsia y a quién se le informaron los resultados de la muerte cardíaca súbita y cuándo.
Por qué esta muerte (que ocurrió dentro del período del informe) y los resultados de la autopsia no se divulgaron públicamente en la reunión del VRBPAC del 10 de diciembre de 2020.
A continuación se muestra un diagrama esquemático simple que destaca las fechas importantes para este sujeto del ensayo.

Analicé más a fondo las muertes y las autopsias realizadas en general en el ensayo. El grupo vacunado tuvo 21 muertes, y solo tres de ellos (sujetos 11141050, 11271112 y 11351033) tuvieron autopsias realizadas.[18] Una autopsia resultó en el diagnóstico de muerte súbita cardíaca (sujeto 11141050), y los otros dos informes aún no están disponibles. Diez de las 21 muertes en los sujetos vacunados ocurrieron en aquellos que fueron encontrados muertos o sufrieron muerte súbita en la edad adulta.[19] De esos 10, solo dos (sujetos 11141050 y 11271112) tuvieron autopsias realizadas, y solo se proporcionó el resultado de una autopsia (sujeto 11141050: muerte súbita cardíaca). El resultado de la autopsia del sujeto vacunado 11271112 aún está pendiente. Hubo 17 muertes en el grupo placebo, y solo cuatro (sujetos 11521085, 11561124, 11681083 y 12314987) tuvieron autopsias. De estos, dos (sujetos 11561124 y 11681083) enumeraron una causa de muerte. Los otros dos resultados aún no están disponibles.
Las autopsias, o más bien la falta de autopsias, en este ensayo se vuelven más pertinentes considerando la revisión sistemática publicada recientemente de los hallazgos de autopsias en muertes después de la vacunación COVID-19. Encontró que el 73,9% de las muertes se adjudicaron de forma independiente como debidas directamente a la vacunación, de las cuales la causa principal de muerte incluyó muerte cardíaca súbita en el 35%. [20]
También quiero destacar otra muerte no revelada de un sujeto vacunado. El sujeto 11201050, de Meridian Clinical Research LLC, Savannah, Georgia, falleció el 7 de noviembre de 2020. Las narraciones de los pacientes indican explícitamente que el centro clínico recibió la notificación de la muerte del sujeto el 7 de noviembre de 2020, de parte de su esposo (Pfizer 2023, p. 75). Esta información está respaldada además por la documentación encontrada en el CRF de ese paciente que indica claramente que la notificación de muerte ocurrió el 7 de noviembre de 2020.[21]
Durante la reunión del VRBPAC del 10 de diciembre de 2020, una de las razones citadas para la aprobación de la vacuna fue que los beneficios conocidos y potenciales de la vacuna superan los riesgos conocidos y potenciales de la vacuna cuando se utiliza para la inmunización activa para prevenir la COVID-19 causada por el SARS-CoV-2 en personas de 16 años de edad o más (Comité Asesor de Vacunas y Productos Biológicos Relacionados, 2020). Cabe destacar que la omisión de los informes de muerte y autopsia del grupo vacunado del estudio en este momento crítico de la emisión de la EUA plantea importantes preocupaciones sobre la información general de seguridad del ensayo clínico de Pfizer. Los pacientes que se ofrecieron como voluntarios para el ensayo clínico probablemente lo hicieron, al menos en parte, en servicio a la humanidad. El hecho de no revelar las muertes de los pacientes, a pesar de la notificación oportuna por parte de sus seres queridos, constituye una traición a su altruismo y confianza y merece una investigación más profunda. También plantea considerables dudas sobre los métodos de notificación en general. Estos métodos han llevado a un gasto médico-financiero nunca visto en el mundo, y posiblemente sobre premisas completamente incorrectas.
Atentamente,
Dra. Jeyanthi Kunadhasan
MD (UKM) MMed (AnaesUM) FANZCA MMED (Monash)

No hay comentarios:
Publicar un comentario