1/ Drosten revela el secreto -
El 03.09.21, el virólogo informó sobre la PLANIFICACIÓN POLÍTICA INTERNACIONAL en la estrategia pandémica, basándose en que aparentemente TODO se había puesto en la tarjeta de VACUNACIÓN de alto riesgo desde el principio:
Drosten sugiere…
1/ Drosten plaudert aus dem Nähkästchen -
— stefanie (@Quo_vadis_BRD) April 24, 2025
Am 03.09.21 berichtete der Virologe von einer INTERNATIONALEN POLITISCHEN PLANUNG bei der Pandemie-Strategie, basierend darauf, dass offenbar früh ALLES auf die hochriskante Karte IMPFUNG gesetzt worden war:
Drosten suggeriert … pic.twitter.com/eypcPcoFhU
2/ ... en este episodio número 97 del podcast de NDR, desde el principio quedó claro científicamente que, basándose en la experiencia en medicina veterinaria, el desarrollo de una vacuna contra el Covid-19 en humanos sería exitoso.
Esto contradice esto:
⬇️
1/ ¿Quién o qué hizo que Christian Drosten tomara decisiones equivocadas en marzo?
Tan recientemente como el 11 de marzo de 2020, calificó las vacunas y los medicamentos para la crisis de la COVID-19 como “CIENCIA FICCIÓN”:
“No habrá ninguno.”
¡Argumentó CONTRA el cierre de escuelas y A FAVOR de proteger a los vulnerables!
2/ … in dieser 97. Folge des NDR-Podcasts, es sei in der Wissenschaft von Beginn an klar gewesen, dass - basierend auf Erfahrungen in der Veterinärmedizin - die Entwicklung einer Impfung gegen Covid-19 beim Menschen erfolgreich sein würde.
— stefanie (@Quo_vadis_BRD) April 24, 2025
Dies steht im Widerspruch hierzu:
⬇️ https://t.co/FtFhTBPj4t
3/ Sin embargo, no sólo el propio Drosten tenía inicialmente serias dudas al respecto (ver episodio 11 del podcast - “Ciencia Ficción”), sino también científicos de la Isla del Príncipe Eduardo, entre ellos Klaus Cichutek, Heidi Meyer, B. Keller-Stanislawski et al. enumerados en el siguiente artículo de ÄRZTEBLATT “teóricos…
3/ Jedoch nicht nur Drosten selbst hatte hieran zunächst größte Zweifel (siehe Podcast-Folge 11 - „Science-Fiction“), sondern auch Wissenschaftler des PEI um Klaus Cichutek, Heidi Meyer, B. Keller-Stanislawski et al. listeten in folgendem Artikel via ÄRZTEBLATT „theoretische … pic.twitter.com/8vvNbKRxD4
— stefanie (@Quo_vadis_BRD) April 24, 2025
La pandemia causada por el SARS-CoV-2 ha provocado un elevado número de hospitalizaciones, enfermedades graves y muertes en todo el mundo (1). Debido a la urgente necesidad de vacunas efectivas y seguras para combatir la pandemia, tanto los desarrolladores como las autoridades reguladoras de medicamentos están priorizando el desarrollo de vacunas. Sin embargo, no se descuida el cuidado necesario en la regulación y la evaluación individual de los productos.
En todo el mundo se están alcanzando acuerdos pertinentes en diversos comités de expertos y grupos de trabajo de la OMS. La Coalición Internacional de Autoridades Reguladoras de Medicamentos (ICMRA) también estableció los criterios para la aprobación de ensayos clínicos con el fin de lograr el equilibrio necesario entre las posibles simplificaciones regulatorias y los requisitos científicos esenciales para el desarrollo de vacunas.
A continuación se resumen los requisitos científicos y reglamentarios que rigen al Instituto Paul Ehrlich (PEI), el Instituto Federal de Vacunas y Biomedicamentos, con respecto a la necesaria aceleración del desarrollo de vacunas preventivas específicas contra la COVID-19.
Fabricación y calidad
De importancia absolutamente fundamental para el desarrollo de vacunas contra la COVID-19 es el diseño y establecimiento de un proceso de fabricación validado y con garantía de calidad (GMP; Buenas Prácticas de Fabricación) que incluya medidas de control apropiadas y controles durante el proceso (Anexo I de la Directiva 2001/83/CE). Para el producto final se debe asegurar que el contenido de ingrediente activo sea constante y que se garantice que el producto final tenga una formulación homogénea.
En el caso de un ensayo clínico de fase I, aún no se espera una validación completa del proceso de fabricación ni de los métodos de prueba de control (reglamento de BPC). El procedimiento de aprobación del ensayo clínico solicitado en el PEI garantiza que el material del ensayo clínico esté suficientemente caracterizado y se haya producido mediante un proceso de fabricación definido y consistente.
Se deberán indicar y justificar las especificaciones del ingrediente activo y del producto final. En el caso de las vacunas contra la COVID-19, no se realizaron ajustes, restricciones o excepciones sustanciales al perfil de calidad requerido.
Proceso de admisión
Los nuevos medicamentos producidos biotecnológicamente, como las vacunas contra la COVID-19, generalmente son aprobados por la Comisión Europea, que otorga al titular de la autorización de comercialización permiso para comercializarlos en la UE y, cuando corresponda, en el Espacio Económico Europeo. Los datos presentados junto con la solicitud de autorización de comercialización son evaluados por los expertos de las autoridades nacionales de medicamentos en un procedimiento centralizado coordinado por la Agencia Europea de Medicamentos (EMA), seguido, si es necesario, de su recomendación conjunta para la autorización de comercialización. Las solicitudes de autorización de comercialización de vacunas candidatas contra la COVID-19 pueden evaluarse mediante una revisión continua, lo que acorta los períodos de evaluación formal.
En circunstancias normales, todos los datos necesarios para la aprobación de un medicamento deben recopilarse y presentarse íntegramente en el momento de la solicitud. Sin embargo, para las vacunas contra la COVID-19, la EMA designó hace meses un panel de expertos, que está listo para evaluar todos los nuevos resultados de estudios tan pronto como estén disponibles. Si se dispone de suficientes datos, el fabricante presenta una solicitud formal de aprobación, sobre la que se puede tomar una decisión rápidamente.
Si no se dispone de todos los datos en el momento de la aprobación, las vacunas contra la COVID-19 pueden estar disponibles más rápidamente a través de una “autorización de comercialización condicional”. Las obligaciones específicas estipulan que los datos faltantes, por ejemplo sobre la eficacia a largo plazo o los datos en subgrupos específicos, deben generarse y presentarse lo más rápidamente posible después de que se haya concedido la aprobación.
El seguimiento y caracterización continuos de la seguridad de una vacuna se definen en un documento separado, el Plan de Gestión de Riesgos (PGR). El RMP se elabora para cada nuevo medicamento aprobado y es una parte habitual de la farmacovigilancia. No constituye un requisito especial en el ámbito de la “aprobación condicional”. Además, tras la aprobación, el Instituto Paul Ehrlich, junto con el Instituto Robert Koch, realizará sus propios estudios sobre la seguridad y la eficacia de las vacunas contra la COVID-19 en uso.
Doctor rer. fisiol. Ralf Wagner,
Profesor Dr. rer. nacional. Eberhard Hildt,
Doctor rer. nacional. Elena Grabski,
Doctor en medicina. Sol Yuansheng,
Doctor rer. tararear. biología. Heidi Meyer,
Doctor en medicina. Annette Lommel,
Doctor en medicina. Brigitte Keller-Stanislawski,
Doctor en medicina. Jan Müller-Berghaus,
Profesor Dr. rer. nacional. Klaus Cichutek
Instituto Paul Ehrlich, Instituto Federal de Vacunas y Biomedicamentos, Langen
Conflictos de intereses:
El Dr. Wagner, el Prof. Hildt, el Dr. Grabski, el Dr. Sun, el Dr. Meyer, el Dr. Müller-Berghaus y el Prof. Cichutek declaran que no existen conflictos de intereses. Los autores del estudio Dr. Keller-Stanislawksi y Dr. Lommel no tienen información sobre conflictos de intereses.
4/ … riesgos” en el desarrollo de vacunas contra el SARS-CoV-2:
1. ADE (mejora dependiente de anticuerpos):
Este riesgo no era en absoluto descabellado, pues ya existían indicios de ello durante el desarrollo de las vacunas contra el SARS-1 y durante la vacunación de un gato (¡medicina veterinaria!):
4/ … Risiken“ bei der Entwicklung von SARS-CoV-2-Impfstoffen auf:
— stefanie (@Quo_vadis_BRD) April 24, 2025
1. ADE (Antibody dependent enhancement):
Dieses Risiko war keineswegs abwegig, gab es hierauf doch bereits bei der Entwicklung von SARS-1-Impfstoffen und bei einer Katzenimpfung (Veterinärmedizin!) Hinweise: pic.twitter.com/2DHzL661za
5/ El 5 de marzo de 2020, incluso Peter Hotez abordó públicamente el peligro de una mejora incontrolable del sistema inmunológico después de una vacuna contra el coronavirus, a través de @tomdabassman.:
Peter Hotez, pediatra y desarrollador de vacunas estadounidense, admitió abiertamente en una audiencia del Senado en marzo de 2020 que las vacunas contra el VRS y el COVID-19 se habían evitado durante 50 años debido a problemas con una mejora incontrolable del sistema inmunológico.
Ugur resolvió el problema en cuatro semanas.
5/ Am 05. März 2020 hatte sogar Peter Hotez die Gefahr unkontrollierbarer Immunverstärkung nach einer Impfung gegen Coronaviren öffentlich adressiert, via @tomdabassman: https://t.co/1bMKCfAn8f
— stefanie (@Quo_vadis_BRD) April 24, 2025
6/ Los autores, liderados por el exjefe del PEI Cichutek, identificaron un “riesgo teórico adicional” en el desarrollo de vacunas contra la Covid-19:
2. Aumento de las enfermedades respiratorias (ERD),
resultando en una “respuesta de anticuerpos no protectora” y un “cambio patológico…
6/ Als ein „weiteres theoretisches Risiko“ bei der Entwicklung von Covid-19-Impfstoffen benannten die Autoren um Ex-PEI-Chef Cichutek:
— stefanie (@Quo_vadis_BRD) April 24, 2025
2. Verstärkte respiratorische Erkrankung (ERD),
mit der Folge einer „nichtprotektiven Antikörperantwort“ und einer „patholog. Verschiebung … pic.twitter.com/Bdmkf1YTey
7/ … la respuesta de las células T colaboradoras (Th) hacia un perfil Th2 mejorado" y la mayor expresión asociada de varias citocinas y la reprogramación de los macrófagos. …
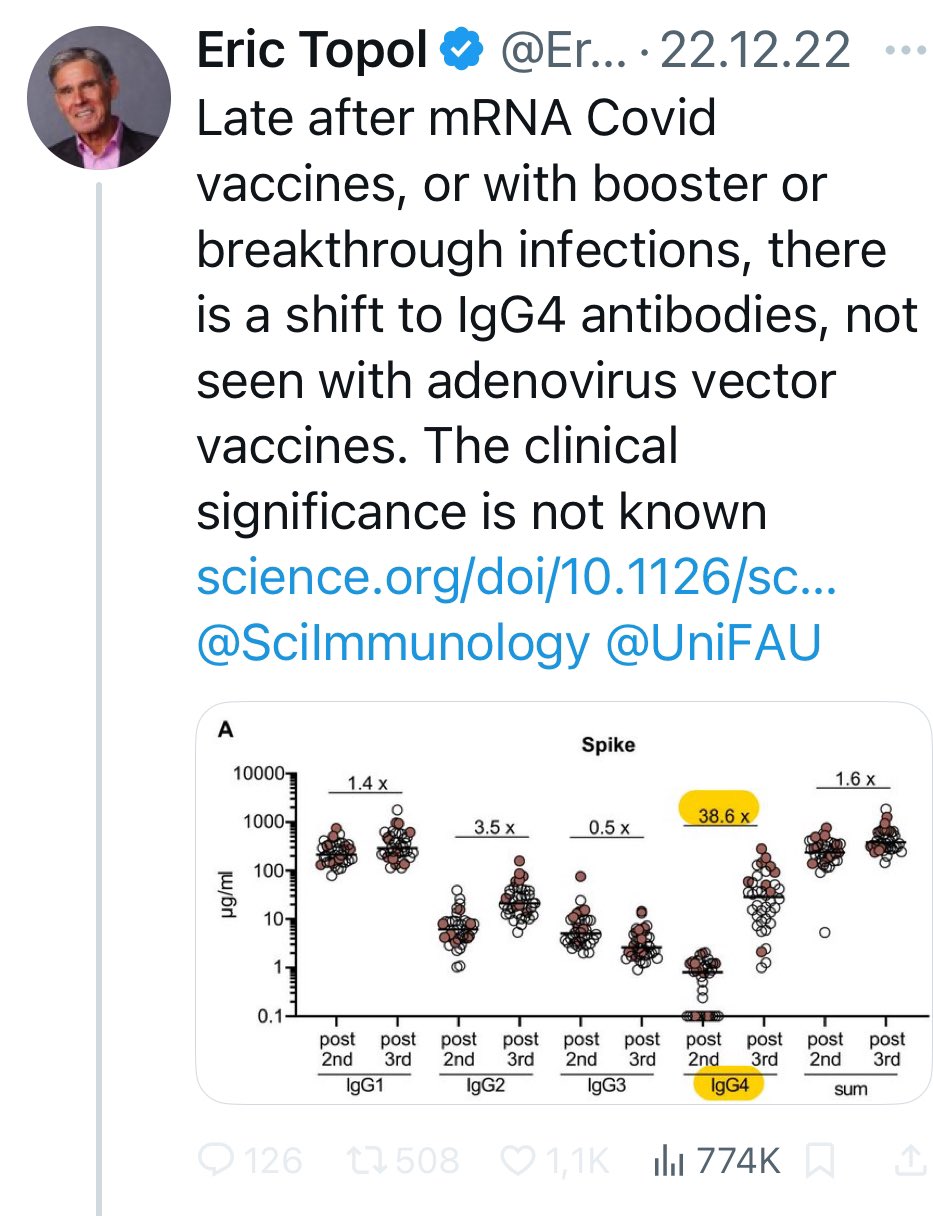
8/ Y he aquí que, ¿no había habido evidencia inmunológica de esta respuesta Th2 mejorada después de múltiples vacunaciones contra la Covid en 2022? Véase @Radbruch_lab?


No hay comentarios:
Publicar un comentario