La vacuna Pfizer-BioNTech COVID-19 (fórmula 2023-2024) no ha sido aprobada ni autorizada por la FDA, pero ha sido autorizada para uso de emergencia por la FDA, bajo una EUA para prevenir la enfermedad por coronavirus 2019 (COVID-19) para su uso en individuos 6 meses hasta los 11 años de edad. El uso de emergencia de este producto solo está autorizado mientras dure la declaración de que existen circunstancias que justifican la autorización de uso de emergencia del producto médico según la Sección 564(b)(1) de la Ley FD&C, a menos que la declaración se dé por terminada o la autorización se revoque antes.
https://www.comirnaty.com/eua-six-months-to-eleven-years
https://www.cdc.gov/vaccines/covid-19/info-by-product/pfizer/downloads/infant-standing-orders.pdf
NUEVA YORK y MAINZ, Alemania, 11 de septiembre de 2023 — Pfizer Inc. (NYSE: PFE, “Pfizer”) y BioNTech SE (Nasdaq: BNTX, “BioNTech”) anunciaron hoy que la Administración de Alimentos y Medicamentos de EE. UU. (FDA) aprobó el Solicitud de licencia de productos biológicos suplementaria (formulación COMIRNATY 2023-2024) para personas de 12 años o más, y se otorgó autorización de uso de emergencia para personas de 6 meses a 11 años de edad para la vacuna monovalente COVID-19 adaptada Omicron XBB.1.5 de las empresas. La vacuna de esta temporada está indicada como dosis única para la mayoría de las personas de 5 años en adelante. Los niños menores de 5 años pueden ser elegibles para recibir dosis adicionales de la vacuna de esta temporada si aún no han completado una serie de tres dosis con formulaciones anteriores de la vacuna COVID-19.
Moderna avanza múltiples programas de vacunas hasta ensayos clínicos en etapa avanzada
Anuncia la vacuna candidata contra la COVID-19 de próxima generación como cuarta vacuna respiratoria que cumple con éxito sus criterios de valoración de la Fase 3
Se esperan dos lecturas más de Fase 3 en 2024, incluida la vacuna combinada contra la gripe y el COVID-19, y la vacuna contra el CMV.
Anuncia datos positivos de ensayos clínicos de tres nuevas vacunas contra virus que causan una carga significativa (virus Epstein-Barr, virus Varicela-Zoster, norovirus) y avanza los programas hacia la Fase 3 de desarrollo
Anticipa el lanzamiento en EE. UU. de la vacuna contra el VRS tras la aprobación de la FDA y la recomendación del ACIP en 2024
Anuncia un acuerdo de financiación de desarrollo y comercialización con Blackstone Life Sciences por hasta 750 millones de dólares para avanzar en el programa contra la gripe
CAMBRIDGE, MA / ACCESSWIRE / 27 de marzo de 2024 / Moderna, Inc. (NASDAQ:MRNA) anunció hoy en su quinto evento del Día de las Vacunas actualizaciones clínicas y de programas que demuestran el avance y la aceleración de su cartera de ARNm. Las actualizaciones incluyen lecturas de datos sobre las carteras de vacunas respiratorias y latentes y otras de la compañía, así como anuncios comerciales, de fabricación y financieros para su negocio de vacunas.
"Nuestra plataforma de ARNm continúa con un historial notable en toda nuestra amplia cartera de vacunas. Hoy, nos complace compartir que cuatro vacunas en nuestra cartera han logrado lecturas clínicas exitosas en nuestras franquicias de virus respiratorios, latentes y otros virus", dijo Stéphane Bancel, director ejecutivo. Oficial de Moderna. "Con cinco vacunas en la Fase 3 y tres más avanzando hacia la Fase 3, hemos creado una cartera muy grande y diversa que aborda importantes necesidades médicas no satisfechas. Estamos centrados en la ejecución para seguir generando impulso en toda nuestra cartera y negocios, y en cumplir con pacientes que se ven afectados por estas enfermedades infecciosas".
Descripción general de la cartera
La cartera de vacunas busca abordar enfermedades infecciosas que causan cargas de salud considerables e incluye 28 vacunas que abordan patógenos respiratorios, latentes y otros patógenos.
Cartera de vacunas latentes y otras vacunas
Moderna está desarrollando cinco vacunas candidatas contra virus que causan infecciones latentes, todas las cuales se encuentran en ensayos clínicos. Cuando está latente, un virus está presente en el cuerpo pero existe en estado de reposo, generalmente sin causar ningún síntoma perceptible. Los virus latentes pueden reactivarse y causar síntomas clínicos a medida que una persona envejece, durante momentos de estrés o cuando la inmunidad está comprometida. La capacidad de latencia es una característica definitoria de los miembros de la familia Herpesviridae, incluidos el citomegalovirus (CMV), el virus de Epstein-Barr (EBV), el virus del herpes simple (HSV) y el virus de la varicela-zoster (VZV).
ARNm-1345
La vacuna candidata contra el VRS de Moderna, mRNA-1345, se encuentra en curso en un ensayo de fase 2/3, aleatorizado, ciego al observador y controlado con placebo (ConquerRSV) en adultos mayores de 60 años. En este estudio, aproximadamente 37.000 participantes de 22 países fueron asignados al azar 1:1 para recibir una dosis de ARNm-1345 o placebo.
Basándose en los datos positivos del ensayo ConquerRSV, Moderna ha solicitado aprobaciones regulatorias para el ARNm-1345 para la prevención de la enfermedad del tracto respiratorio inferior asociada al VRS (RSV-LRTD) y la enfermedad respiratoria aguda (ERA) en adultos mayores de 60 años.
El ensayo cumplió sus dos criterios de valoración principales de eficacia, con una eficacia de la vacuna (EV) del 83,7% (IC del 95,88%: 66,1%, 92,2%; p<0,0001) contra RSV-LRTD definida por dos o más síntomas, y una EV de 82,4% (IC 96,36%: 34,8%, 95,3%; p=0,0078) contra RSV-LRTD definido por tres o más síntomas. Estos datos se publicaron en el New England Journal of Medicine en diciembre de 2023.
Recientemente se presentó un análisis posterior del estudio ConquerRSV con una mediana de duración de seguimiento más larga de 8,6 meses (frente a 3,7 meses en el análisis primario), con un rango de 15 días a 530 días, e incluyendo sujetos de los hemisferios norte y sur. en la conferencia RSVVW'24. En este análisis complementario, mRNA-1345 mantuvo una eficacia duradera, con una EV sostenida del 63,3 % (IC del 95,88 %: 48,7 %, 73,7 %) contra RSV-LRTD, incluidos dos o más síntomas. La EV fue del 74,6 % (IC del 95 %: 50,7 %, 86,9 %) contra RSV-LRTD con ≥2 síntomas, incluida dificultad para respirar y del 63,0 % (IC del 95 %: 37,3 %, 78,2 %) contra RSV-LRTD, incluidos tres o más síntomas. El estricto criterio estadístico del estudio, un límite inferior en el IC del 95% de >20%, se siguió cumpliendo para ambos criterios de valoración.
La FDA ha concedido al ARNm-1345 la designación de Terapia Innovadora para la prevención del RSV-LRTD en adultos mayores de 60 años. La Compañía está a la espera de las aprobaciones regulatorias y la recomendación del ACIP de EE. UU. en 2024.
Estudios de expansión de indicaciones para mRNA-1345.
El ARNm-1345 tiene el potencial de proteger a todas las poblaciones vulnerables del VSR. Moderna ha iniciado múltiples estudios de expansión de Fase 3 en adultos mayores de 50 años para evaluar la coadministración y la revacunación. Se han iniciado ensayos adicionales (Fase 1 - Fase 3) para adultos de alto riesgo, así como para poblaciones maternas y pediátricas. Los datos provisionales de estos estudios podrían estar disponibles a partir de 2024.
Fabricación
La innovación en fabricación de la compañía respalda la expansión de la comercialización de una cartera diversa a través de ganancias de eficiencia y productividad. Su plataforma de fabricación de ARNm permite beneficios como calidad, velocidad, escala y rentabilidad en un espacio que incluye ampliamente la fabricación de plásmidos, ARNm, nanopartículas lipídicas, así como capacidades de control de calidad y llenado/acabado.
A medida que la Compañía continúa construyendo su presencia para el futuro, está desarrollando una red de fabricación global ágil para satisfacer la demanda comercial y respaldar su creciente cartera. La fabricación desde preclínica hasta comercial se lleva a cabo en el Centro de Tecnología Moderna en Norwood, Massachusetts, que sigue siendo fundamental para la red de la Compañía. Se espera que las nuevas instalaciones que se están construyendo en Australia, Canadá y el Reino Unido entren en funcionamiento en 2025, y la capacidad de productos farmacéuticos se logra a través de una red flexible de fabricación por contrato. Además, la compañía compró e inició la construcción de un sitio de fabricación en Marlborough, Massachusetts, para permitir la escala comercial de su programa de terapia de neoantígenos individualizado.
Al continuar siendo pionera en nuevas tecnologías, incluida la robótica avanzada, la aplicación de inteligencia artificial y otras soluciones digitales, y el impulso de la eficiencia de la red y del capital, se espera que la red de fabricación de Moderna también genere costos de ventas más predecibles.
Moderna (MRNA) publica avances en su canalización y obtiene financiación de Blackstone
https://finance.yahoo.com/news/moderna-mrna-posts-pipeline-progress-153800956.html
Las acciones de Moderna MRNA subieron un 3% el miércoles después de que la dirección anunciara actualizaciones clínicas positivas en su evento del Día de las Vacunas, destacando el progreso de su cartera.
Si bien la compañía proporcionó una actualización sobre múltiples candidatos en proceso, anunció su decisión de avanzar tres vacunas hacia un desarrollo fundamental en la última etapa. Estos incluyen mRNA-1189 (para el virus de Epstein-Barr [EBV]), mRNA-1468 (para el virus Varicella-Zoster [VZV]) y mRNA-1405 (para norovirus).
La decisión de avanzar con estas vacunas candidatas se basa en datos de estudios clínicos separados en etapa inicial sobre estas vacunas. Los datos de estos estudios mostraron que las vacunas eran inmunogénicas y bien toleradas entre los participantes del estudio.
Moderna está evaluando actualmente múltiples terapias en etapa avanzada de desarrollo, que incluyen mRNA-1647 (para citomegalovirus [CMV]), mRNA-4157 (terapia de neoantígeno individualizado [INT]) y mRNA-1083 (una vacuna combinada dirigida tanto a COVID-19 como a influenza).
Los ingresos de Moderna dependen en gran medida de su vacuna COVID-19, cuyas ventas han disminuido significativamente en todo el mundo. Pasar otras tres vacunas a una etapa avanzada de desarrollo acerca a Moderna a tener múltiples productos en el mercado. La dirección cree que la cartera de vacunas de la empresa se dirige a grandes mercados direccionables, con un mercado direccionable total estimado (TAM) de alrededor de 52.000 millones de dólares para vacunas contra enfermedades infecciosas.
Además del comunicado de prensa, Moderna también anunció que ha firmado un acuerdo de financiación con Blackstone Life Sciences. Según los términos del acuerdo, Blackstone financiará hasta 750 millones de dólares para avanzar en el programa contra la influenza de la compañía a cambio de posibles pagos por hitos y regalías bajas de un solo dígito.
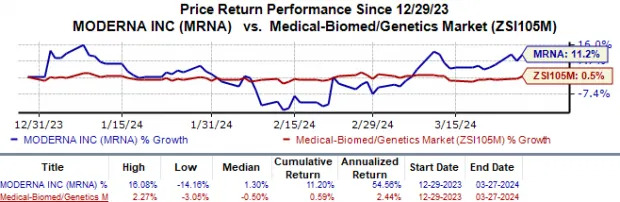
En lo que va del año, las acciones de Moderna han subido un 11,2% en comparación con el crecimiento del 0,6% de la industria.
Fuente de la imagen: Zacks Investment Research
A principios de esta semana, Moderna informó resultados positivos de un estudio fundamental de fase III que evalúa el ARNm-1283, su vacuna COVID-19 estable en refrigerador de próxima generación, en personas de 12 años o más. El estudio logró su criterio de valoración principal, mostrando que las personas que recibieron ARNm-1283 generaron una respuesta inmune más alta en comparación con la vacuna COVID bivalente dirigida Omicron BA.4/BA.5 de Moderna previamente aprobada.
Los resultados anteriores pretenden reforzar la confianza en el ARNm-1083, que es una formulación combinada de ARNm-1283 y ARNm-1010 de la vacuna contra la influenza.
MRNA también tiene la intención de iniciar una presentación regulatoria ante la FDA para mRNA-1010 como vacuna independiente contra la influenza antes de fin de año. El año pasado, la gerencia informó datos alentadores de un estudio de inmunogenicidad en etapa avanzada (P303) y un estudio comparativo de fase I/II separado que evaluó esta vacuna contra la gripe. Los participantes tratados con mRNA-1010 provocaron respuestas inmunes más altas en las cuatro cepas A y B de influenza en comparación con las vacunas autorizadas comercializadas por GSK y Sanofi.
Moderna anticipa la aprobación de la FDA para su vacuna contra el VSR mRNA-1345 para su uso en adultos mayores de 60 años o más. Se espera una decisión final antes del 12 de mayo. Si se aprueba, mRNA-1345 podría ser el segundo lanzamiento de producto de Moderna, cuyo lanzamiento comercial se espera para el tercer trimestre de 2024. Moderna también está trabajando en ampliar el uso de mRNA-1345 en poblaciones pediátricas.
La administración está en camino de informar datos sobre estudios en etapa avanzada que evalúan mRNA-1647 y mRNA-1083 a finales de este año.
Moderna desarrolla vacunas de ARNm para enfermedades relacionadas con las vacunas COVID
https://childrenshealthdefense.org/defender/moderna-mrna-vaccines-diseases-linked-covid-shots/
Durante su evento del Día de las Vacunas para inversores el 28 de marzo, Moderna anunció avances en múltiples vacunas basadas en ARNm y candidatos terapéuticos en su “pipeline”.
Tres vacunas dirigidas al virus de Epstein-Barr (EBV), al virus de la varicela-zoster (VZV, varicela y culebrilla) y al norovirus están avanzando hacia una “etapa fundamental de desarrollo”, dijo la compañía.
Moderna también anunció que se espera que la Administración de Medicamentos y Alimentos de EE. UU. (FDA) apruebe su vacuna contra el virus respiratorio sincitial (VRS) mRNA-1345 para adultos mayores. Esto es parte de un mercado esperado de 52 mil millones de dólares para las vacunas contra enfermedades infecciosas de Moderna.
"Continuamos explorando la aplicación del ARNm en el tratamiento potencial de enfermedades cardiovasculares y otras enfermedades vasculares isquémicas", afirma el sitio web de Moderna en sus planes de productos para áreas terapéuticas.
La empresa también está desarrollando soluciones de ARNm para el cáncer y las enfermedades autoinmunes.
Citando las reacciones adversas bien documentadas y a menudo graves a las vacunas de ARNm contra la COVID-19, algunos científicos y médicos dijeron que están preocupados por los peligros de las formulaciones de ARNm nuevas y existentes.
También cuestionan si Moderna está intentando sacar provecho de las soluciones para las enfermedades que causan sus productos.
Bloquear a los “soldados de infantería del sistema inmunológico”
El ARN modificado sintético (modRNA) en las células suprime la inmunidad innata que mantiene a raya los virus latentes y protege contra nuevas infecciones, según Brian Hooker, Ph.D., director científico de Children's Health Defense.
"Uno de los mecanismos implica microARN que suprimen la producción de interferón celular, que es extremadamente importante para el ataque contra infecciones virales así como para la supresión de tumores", dijo Hooker a The Defender.
Hooker señaló el artículo de junio de 2022 de Stephanie Seneff, Ph.D., el Dr. Peter McCullough y otros que exploraron la supresión inmune innata mediante vacunas de ARNm.
Los autores propusieron que la supresión del interferón inducida por la vacuna bloquea el funcionamiento adecuado de las células T CD8+, a menudo llamadas soldados de infantería del sistema inmunológico, permitiendo que los virus latentes se reactiven y, en el caso del VZV, causen culebrilla, la versión “adulta”. de varicela.
Un artículo de 2021 informó 54 casos de herpes zoster (culebrilla) que surgieron un promedio de 7 días después de la vacunación contra el COVID-19. Un artículo de 2022 informó 10 casos de reactivación del herpes zoster entre una y tres semanas después de la vacunación contra el COVID-19.
Sin embargo, los autores de ambos artículos afirmaron que no se podía establecer un vínculo definitivo entre las vacunas y los síntomas.
La científica francesa Hélène Banoun, Ph.D., en “La Science face au Pouvoir: Ce que révèle la crise Covid-19 sur la biopolitique du XXIe siècle” (“Ciencia versus poder: lo que la crisis de Covid-19 revela sobre el siglo XXI biopolítica”), escribió que la desorganización del sistema inmunológico innato y sus receptores contribuye a la reactivación de virus latentes, incluidos el herpes, el herpes zóster, el virus del papiloma humano (VPH) y el VRS.
Según Banoun, muchas personas infectadas por EBV o VZV se convierten en portadores sanos y asintomáticos.
"Estos virus, así como otros virus o bacterias, como el bacilo de Koch responsable de la tuberculosis, pueden permanecer inactivos durante toda la vida o reactivarse durante la inmunosupresión", dijo Banoun a The Defender.
Banoun también citó reacciones de lepra después de inyecciones de ARNm observadas en numerosos países. "A pesar de la sofisticación de las vacunas de ARNm, algunos efectos secundarios aparentemente reactivan enfermedades que se creían relegadas al pasado", escribió.
Numerosos estudios de casos (aquí, aquí y aquí) correlacionan el desarrollo de síntomas y anticuerpos relacionados con el VEB con las vacunas de ARNm de COVID-19.
Matthew Matlock, un veterano de combate y atleta Ironman, informó en la reunión de abril de 2022 del Comité Asesor de Vacunas y Productos Biológicos Relacionados de la FDA que sufrió la reactivación del VEB, además de problemas cardíacos y de enfermedades de los mastocitos, después de recibir la vacuna. Segunda dosis de la vacuna COVID-19 de Pfizer.
Moderna está creando dos versiones de una vacuna contra el VEB: mRNA-1189 para la prevención y mRNA-1195 para abordar los efectos a largo plazo, específicamente la esclerosis múltiple y una subcategoría de linfoma en pacientes con trasplante de órganos sólidos.
Según se informa, Moderna detuvo su ensayo de vacuna contra el VEB el año pasado cuando un sujeto desarrolló miocarditis.
Moderna no menciona otros efectos del EBV a largo plazo, como el EBV activo crónico, los cánceres asociados al EBV, la anemia, la rotura del bazo, la trombocitopenia, la hepatitis, la miocarditis y las enfermedades del sistema nervioso, incluidas la encefalitis, la meningitis y el síndrome de Guillain-Barré.
El director general de Moderna, Stéphane Bancel, dijo que se espera que el mercado de las vacunas contra el VEB ascienda a varios miles de millones de dólares.
Turbocánceres y enfermedades autoinmunes.
Banoun destacó el papel de la IgG4 anti-pico (subtipo de inmunoglobina 4) en la inmunotolerancia inducida por pico, y escribió que “sustituye a otras IgG después de vacunaciones repetidas” y aumenta la expresión de PD-L1 (ligando 1 de muerte celular programada), que puede evitar que las células T del sistema inmunológico ataquen y maten a las células cancerosas.
IgG4 es un anticuerpo que produce el sistema inmunológico en respuesta a infecciones o vacunas. Tiene propiedades antiinflamatorias pero también puede unirse a los mismos objetivos que otros anticuerpos, bloqueando su eficacia.
La sobreexpresión de IgG4 puede provocar una enfermedad relacionada con IgG4, una afección inflamatoria crónica con lesiones que pueden desregular el funcionamiento de los órganos e incluso causar la muerte.
Según un estudio de 2023, los anticuerpos IgG4 inducidos por vacunaciones repetidas pueden generar tolerancia inmune a la proteína de pico del SARS-CoV-2, lo que hace que las vacunas de ARNm sean ineficaces.
Mikolaj Raszek, Ph.D., especialista en secuenciación genómica y fundador y director de Merogenomics, citó en un tweet reciente un artículo de enero de 2024 en Viruses que muestra anticuerpos IgG4 anormales en casi todos los individuos vacunados con ARNm:
"Están sugiriendo que tener demasiado antígeno eventualmente conducirá al agotamiento de las células T, y si hay agotamiento de las células T, así es como se podría comenzar a correlacionar eso con el desarrollo de la autoinmunidad...
"Cada vez más científicos desconfían de estos anticuerpos IgG4 que básicamente parecen observarse en casi todos los individuos vacunados con ARNm".
Los autores del artículo sobre Virus señalaron que un nivel elevado de IgG4 en el suero se considera patógeno, ya que podría desencadenar enfermedades autoinmunes, cáncer y otras enfermedades.
Especularon que esto podría deberse a la proteína de pico de larga duración producida por las vacunas y sugirieron que esto podría conducir a la desensibilización de las células T CD4+ y CD8+, lo que llevaría al agotamiento del sistema inmunológico.
“La inducción de tolerancia inmunológica mediante vacunaciones repetidas quizás podría explicar el gran número de muertes que se producen entre personas vacunadas que recibieron una tercera dosis en comparación con personas no vacunadas en algunos países europeos”, escribieron.
En su artículo, Seneff y McCullough vincularon la inmunosupresión inducida por vacunas con enfermedades neurodegenerativas, miocarditis, trombocitopenia inmune, parálisis de Bell, enfermedades hepáticas, cáncer y otras deficiencias.
Geert Vanden Bossche, Ph.D., también advirtió que los niveles elevados de IgG4 inducidos por la vacuna podrían provocar turbocánceres. Muchos oncólogos han informado sobre cánceres que se desarrollan rápidamente, a menudo en personas más jóvenes, que ya han progresado a la etapa 3 o 4 en el momento en que se diagnostican.
Banoun dijo que hasta hace unos años, Moderna desarrollaba vacunas de ARNm únicamente para combatir el cáncer. "Es cierto que estamos asistiendo a un aumento en la incidencia de cáncer debido, sin duda, a los ARN anti-COVID", dijo.
Banoun dijo que el producto mRNA-6981 que Moderna está desarrollando está diseñado para aumentar los niveles de PD-L1 para prevenir la progresión de la hepatitis autoinmune al limitar la autorreactividad del sistema inmunológico.
Sin embargo, como ya se señaló, un nivel elevado de PD-L1 puede bloquear las propiedades del sistema inmunológico para combatir el cáncer.
"Esta terapia es un arma de doble filo, ya que no será específica y corre el riesgo de inducir inmunotolerancia a otras patologías como infecciones y cánceres", dijo Banoun. "Moderna podrá entonces desarrollar otros ARNm contra los cánceres inducidos".
Otros ARNm dirigidos al cáncer en la cartera de Moderna incluyen el ARNm-4157 para melanoma y cáncer de pulmón de células no pequeñas (NSCLC); ARNm-5671 para NSCLC, cánceres de páncreas y colorrectal; ARNm-4359 para “estimular las células T efectoras que atacan y matan a las células inmunes supresoras y cancerosas que expresan altos niveles de antígenos de punto de control diana”; y mRNA-2752 para inyección directa en tumores y linfomas.
Moderna también dijo que está desarrollando varias terapias de ARNm que cree que "tienen el potencial de ayudar a millones de pacientes que luchan contra enfermedades autoinmunes".
La proteína de pico del SARS-CoV-2 puede causar muchas de las mismas enfermedades
Moderna también puede estar respondiendo a enfermedades causadas por la proteína de pico en el propio virus SARS-CoV-2 original.
En este momento existe amplia evidencia que sugiere que el virus fue diseñado específicamente para ser más virulento para los humanos.
Los investigadores en este estudio de 2022 de personas infectadas con COVID-19 encontraron niveles elevados de anticuerpos relacionados con el VEB, así como de anticuerpos contra el virus del herpes 6A y el retrovirus K endógeno humano.
Los síntomas atribuidos al “COVID prolongado” (que pueden incluir síntomas atribuibles a las vacunas de ARNm) incluyen dificultad para respirar, dolor en el pecho, palpitaciones del corazón, fatiga, confusión mental, problemas para dormir, mareos, sensación de hormigueo, malestar post-ejercicio, un cambio en el olfato o el gusto, depresión o ansiedad, dolor de estómago o diarrea, dolor en las articulaciones o músculos, erupciones cutáneas y cambios en los ciclos menstruales.
El sitio web de los Centros para el Control y la Prevención de Enfermedades afirma que estos síntomas son similares a los reportados por personas con síndrome de fatiga crónica, también conocida como encefalomielitis miálgica.
La Dra. Michelle Perro, pediatra de medicina integrativa y directora ejecutiva de GMO Science, dijo a The Defender que debido a que las personas con COVID prolongado pueden tener una exacerbación de infecciones crónicas subyacentes, “la producción de vacunas de ARNm, que son problemáticas por la experiencia con COVID, es defectuoso en el mejor de los casos”.
“Estas vacunas estaban en proceso mucho antes de la COVID y obtuvieron el visto bueno de la EUA [autorización de uso de emergencia] para liberar la tecnología”, dijo Perro.
"No hay nada bueno que decir sobre el uso de este proceso [ARNm] en el desarrollo de 'vacunas'", afirmó. "Esta tecnología debería abandonarse inmediatamente hasta que haya más datos disponibles".
Moderna ha estado impulsando recientemente una campaña de vacunación destinada a una prevención prolongada del COVID.
"¡Hola culebrilla!" Las vacunas existentes pueden ser causa de enfermedades
Es posible que las inyecciones de ARNm no sean las únicas responsables del resurgimiento de virus como la varicela. En su publicación de Substack del 29 de marzo, Jennifer Margulis habló sobre la vacuna contra la varicela y su relación con el aumento de los casos de culebrilla.
Hasta que se añadió la vacuna contra la varicela al calendario de vacunación infantil en 1995, el virus se asociaba con “sólo 100 muertes cada año de casi 4 millones de casos”, escribió.
Margulis cuestionó por qué una enfermedad tan relativamente leve necesitaría una vacuna si el propósito de las vacunas programadas era prevenir enfermedades graves. Señaló que menos de un tercio de los países europeos recomiendan siquiera la vacunación universal para los niños.
Citando un estudio de 2022, Margulis destacó algunas de las reacciones adversas graves a la vacuna contra la varicela, incluidas meningitis, encefalitis y muerte. Otros efectos adversos informados incluyen trombocitopenia, neumonía, erupciones cutáneas graves, infecciones de la piel y convulsiones.
Margulis argumentó que eliminar el virus salvaje de la circulación mediante campañas de vacunación a gran escala había reducido la inmunidad natural de los adultos a quienes en el pasado se les permitía combatir la infección cuando eran niños.
"Este impulso natural de la inmunización prácticamente ha desaparecido", dijo, y agregó: "¡Hola, culebrilla!". y señalando que “el ARNm-1468 es la vacuna que Moderna está desarrollando para ayudar a proteger a los adultos del herpes zóster”.
Más productos en cartera de Moderna
Otros productos en cartera de Moderna incluyen una vacuna contra el VIH, una vacuna combinada contra el VRS y el VPH, una vacuna pediátrica contra el VRS, una vacuna contra la gripe pandémica, una vacuna contra el citomegalovirus y una vacuna endémica contra el HCoV (coronavirus humano); vacunas contra la enfermedad de Lyme, Zika, Nipah y Mpox; un terapéutico para promover la relaxina, una hormona cardioprotectora natural; y una vacuna combinada contra la gripe COVID-19.
Blackstone Life Sciences acordó invertir 750 millones de dólares en la vacuna contra la gripe de Moderna a cambio de pagos por hitos y regalías, informó Yahoo Finance.
El valor de las acciones de Moderna subió un 3% después de los anuncios, acercándose a los 111 dólares por acción, lo que eleva el aumento de 2024 al 11,2% al 28 de marzo, muy por encima del promedio de la industria.
El precio actual todavía está muy por debajo del precio de 450 dólares por acción que Moderna disfrutaba a mediados de 2021, en el apogeo del lanzamiento de la vacuna COVID-19.
DARPA otorga a Moderna hasta 56 millones de dólares para permitir la fabricación móvil rápida y a pequeña escala de vacunas y productos terapéuticos de ácido nucleico
October 8, 2020
CAMBRIDGE, Massachusetts--(BUSINESS WIRE)--Oct. 8 de septiembre de 2020-- Moderna, Inc., (Nasdaq: MRNA), una empresa de biotecnología pionera en terapias y vacunas de ARN mensajero (ARNm) para crear una nueva generación de medicamentos transformadores para los pacientes, anunció hoy un acuerdo para un compromiso de hasta $56 millones de la Agencia de Proyectos de Investigación Avanzada de Defensa (DARPA) para financiar el desarrollo de un prototipo de fabricación móvil que aproveche la tecnología de fabricación existente de Moderna y que sea capaz de producir rápidamente vacunas y terapias. El acuerdo se basa en una subvención de asistencia anterior con DARPA establecida en 2013.
El premio es parte de la iniciativa Nucleic Acids On Demand World-Wide (NOW) de DARPA para desarrollar una plataforma de fabricación automatizada móvil de extremo a extremo para proporcionar fabricación en el campo, justo a tiempo, con calidad de Buenas Prácticas de Fabricación (GMP). Vacunas y terapias de ácido nucleico (incluido ARNm) destinadas a brindar protecciones y tratamientos casi instantáneos tanto al personal militar como a las poblaciones locales. El diseño prevé una unidad de fabricación capaz de producir cientos de dosis de medicamentos en cuestión de días en un contenedor de 6 pies x 6 pies x 6 pies (1,8 mx 1,8 mx 1,8 m) en lugares remotos de todo el mundo.
“Nos complace continuar nuestra colaboración con DARPA con un nuevo premio y esperamos aprovechar nuestra experiencia en el diseño y fabricación rápida de vacunas como se demostró con mRNA-1273, nuestra vacuna COVID-19 actualmente en un estudio de Fase 3, y mRNA- 4157, nuestra vacuna personalizada contra el cáncer actualmente en un estudio de fase 2”, dijo Stéphane Bancel, director ejecutivo de Moderna. “Este nuevo premio nos permitirá explorar el alcance de nuestra tecnología para permitir potencialmente la fabricación rápida, automatizada y en el campo de vacunas y terapias tanto para personal militar como para civiles en todo el mundo en un contenedor que se puede implementar rápidamente para fabricar vacunas personalizadas. o terapéutica. La capacidad de fabricar medicamentos en una unidad móvil podría tener un impacto importante en la capacidad de responder a futuros desafíos virales. Moderna se compromete a ser parte de la solución para prevenir futuras pandemias”.
El apoyo financiero de DARPA al programa NOW es parte del compromiso de la Agencia de crear enfoques biotecnológicos innovadores para detectar, caracterizar y mitigar rápidamente las amenazas de patógenos recientemente emergentes o diseñados.
ROBERT MALONE JEFE DE INVESTIGACIÓN DE DOMANE <DARPA/DTRA>
👉ROBERT MALONE JEFE DE INVESTIGACIÓN DE DOMANE
2. Soy el inventor original de la tecnología básica de vacunación con ARNm y ADN; he estado involucrado en el desarrollo, diseño y supervisión de aproximadamente cuarenta estudios clínicos de fase 1, ensayos clínicos y veinte ensayos clínicos de fase 2, así como cinco ensayos clínicos de fase 3; han estado involucrados en enfermedades infecciosas patógeno desarrollo avanzado supervisión del VIH, influenza, peste, Ántrax, EEV/EEE/WEE, tularemia, tuberculosis, ébola, Zika, toxina de ricina y patógenos; y, desde enero de 2020, lideramos un gran equipo centrado en la investigación clínica, diseño, desarrollo de fármacos, modelado informático y mecanismos de acción de fármacos reutilizados para el Tratamiento del COVID-19.
3. Presento esta declaración en apoyo de los argumentos de los Demandantes de que (a) la vacuna Pfizer-BioNTech COVID-19 y la vacuna COMIRNATY COVID-19 son legalmente distintas; y (b) Actualmente no hay vacunas autorizadas contra el SARS-CoV-2 disponibles en los EE. UU. Más bien, todos los disponibles actualmente, Las dosis de vacunas contra el SARS-CoV-2 son productos médicos experimentales disponibles bajo el Estatutos y autorizaciones de uso de emergencia (EUA
11. Actualmente me desempeño como director ejecutivo y consultor principal de RW Malone MD LLC, principalmente apoyando al Departamento de Defensa de EE. UU., Agencia de Reducción de Amenazas de Defensa (a través de contratos celebrados por Leidos y MIT-Lincoln Lab).
👉TRABAJOS CIENTÍFICOS SOBRE LA COVID 19 HECHOS POR DOMANE
El
autor agradece al Departamento de Defensa (DoD), la Agencia de
Reducción de Amenazas de Defensa (DTRA) y la Oficina Conjunta de Ciencia
y Tecnología (JSTO) del Programa de Defensa Química y Biológica (CBDP)
por su apoyo bajo el descubrimiento de contramedidas médicas contra
Novel Iniciativa de las Entidades (DOMANE).
El brazo terapéutico de DTRA se apoya en medicamentos asequibles y aprobados por la FDA para el alivio del COVID-19
"A finales de 2019, la DTRA inició un nuevo programa llamado Descubrimiento de contramedidas médicas contra entidades novedosas (DOMANE) para abordar amenazas nuevas y emergentes", afirmó el Dr. David Hone, científico jefe de la División de Vacunas y Terapéutica de la DTRA. “Basándonos en trabajos anteriores, decidimos que DOMANE no solo se centraría en medicamentos aprobados por la FDA sino también en terapias combinadas, ya que creemos que ningún medicamento por sí solo será completamente eficaz en el tratamiento de nuevas enfermedades. COVID-19 nos ha brindado la oportunidad de probar nuestras hipótesis utilizando DOMANE”.
Acerca de DTRA:
La
Agencia de Reducción de Amenazas de Defensa permite al Departamento de
Defensa, al gobierno de los Estados Unidos y a los socios
internacionales contrarrestar y disuadir las armas de destrucción masiva
y las redes de amenazas improvisadas.

No hay comentarios:
Publicar un comentario